По-точна „ножица“ ще редактира гените ни
През 2013 година статия на младия биолог Фън Чжан (Feng Zhang) и колегите му в сп. Science направила истинска революция в света на генното инженерство.
Въз основа на опита от предишни изследвания учените предложили прост и ефективен начин за редактиране на ДНК на всякакви живи организми – от дрожди и селскостопански култури до човека – с използването на молекулярен механизъм, открит при едноклетъчните.
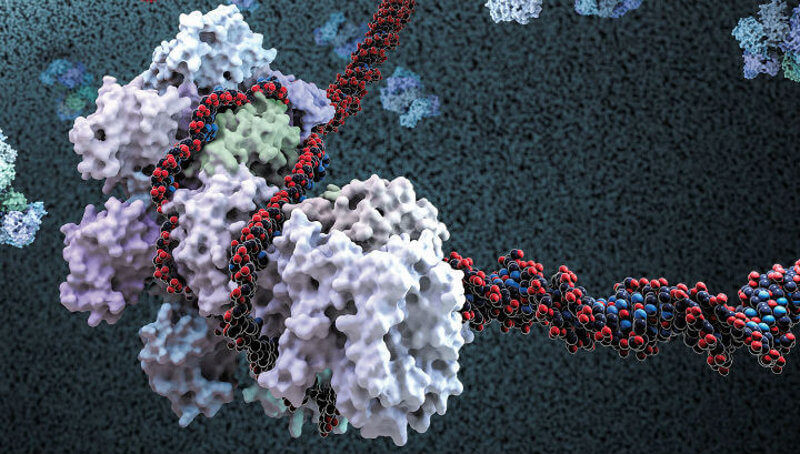
Системата, получила названието CRISPR (clustered regularly interspaced short palindromic repeats), се появила в резултат на противостоянието между бактериите и техните главни врагове – вирусните бактериофаги. С нейна помощ подложените на нападение клетки по късия фрагмент на ДНК разпознават щамовете на инфекциозните агенти, с които вече са се срещали техните предци.
Насочващите РНК подават към разпознатия участък от генетичния код на вируса фрагмент-ножица, който унищожава врага, като разрязва веригата.
Тези комплекси се оказали изключително сложни, но изследователите се научили да управляват системите, използващи белтъка Cas9 в качеството на ножица, за да изрязват генетични грешки, да изменят или да добавят фрагменти ДНК в най-различни клетки.
Но с този метод е доста сложно да се вгради нов участък в генома. Затова молекулярните биолози не спрели дотук и веднага започнали да търсят възможност да подобрят точността на инструмента. И изглежда, Чжан, на когото работата с CRISPR/Cas9 вече е донесла професорска титла и собствена лаборатория в Масачузетския технологичен институт, отново е спечелил надпреварата.
Неговият екип е прехвърлил стотици фрагменти, които потенциално биха могли да послужат като молекулярен скалпел. Вниманието на учените привлякъл белтъкът Cpf1, който използва някои бактерии с CRISPR. Като оценили ефективността на ензимите Cpf1, отделени от 16 различни вида едноклетъчни, учените открили, че два от тях могат да бъдат използвани в човешките клетки.
Както става ясно от статията, публикувана в сп. Cell, главното преимущество на Cpf1 в сравнение с Cas9 е по-малкият размер, което облекчава преноса на молекулите в зрелите клетки. Освен това новият фрагмент изисква само една насочваща РНК, докато Cas9 има нужда от две молекули. Такива системи ще могат много по-лесно и евтино да се изготвят, като точността във внасяните изменения ще бъде по-висока, съобщават Чжан и колегите му.
Начинът на разрязване на ДНК при двата белтъка се оказал различен. Cas9 реже двете ДНК нишки на едно и също място, оставяйки така наречените тъпи краища. Cpf1 създава на мястото на разреза „лепливи краища“, като едната нишка е срязана малко по-късо от другата. В първия случай работата с молекулата ДНК е по-трудна, тъй като новият фрагмент понякога случайно може да се прикрепи към грешната нишка. „Лепливите нишки“ се различават, което позволява по-точно да се прикрепи фрагментът на необходимото място.
„Още е прекалено рано да говорим дали новият белтък ще надмине Cas9 по популярност – разказва Чжан. – Но отсега е ясно, че той има редица важни преимущества.“
Само за три години системата CRISPR/Cas9 е получила такова разпространение, че е предизвикала жестока патентна война между научните центрове. Чжан обещава, че лабораторията му ще направи новите компоненти достъпни за академични изследвания, както това е било с предишните разработки.
Естествено, колеги и конкуренти на учение не възнамеряват да спират собствените търсения на нови елементи в системата за редактиране на гени. Те казват, че в областта на генното инженерство никога не знаеш с точност какви инструменти ще се окажат по-добри в бъдеще.








